Wissen aus dem Bereich GxP-Compliance
Der Wissensbereich GxP-Grundlagen beantwortet Fragen rund um das Thema GxP-Compliance. Sie finden Informationen zu den relevanten Normen und Richtlinien und den Anforderungen an eine GMP-gerechte Dokumentation.
Hier finden Sie Antworten auf die folgenden Fragen:
- Was versteht man unter GxP?
- Welche Normen und Richtlinien spielen im GMP-Umfeld eine Rolle?
- Welche Branchen bewegen sich in einem GMP-regulierten Umfeld?
- Welchen Anforderungen muss eine GMP-gerechte Dokumentation entsprechen?
- Wie wird das Risikomanagement in der Guideline ICH Q9 definiert?
- Was sind die Grundsätze des Risikomanagements in GxP-regulierten Bereichen?
- Welche Ziele verfolgt das Risikomanagement in GxP-regulierten Bereichen?
- Welche Methode eignet sich für Risikoanalysen von Unternehmen mit GxP-Compliance Anforderungen?
Was versteht man unter „GxP“?
GxP ist der Überbegriff für spezifische GMP-regulierte Teilbereiche, wie beispielsweise:
- GMP = Good Manufacturing Practice
- GSP = Good Storage Practice
- GDP = Goof Distribution Practice
- GEP = Good Engineering Practice
- GAMP = Good Automated Manufacturing Practice
Welche Normen und Richtlinien spielen im GMP-Umfeld eine Rolle?
Überblick über die wichtigsten Regelwerke im GMP-Umfeld:
- Nationale Regularien für Deutschland: Arzneimittelgesetz (AMG) / Arzneimittel- und Wirkstoffherstellungsverordnung (AMWHV)
- EU-Regularien: EU-GMP-Leitfaden Teil I-III inkl. Annexe
- US-Regularien: FDA Code of Federal Regulations (CFR)
- Internationale Regularien: ICH-Guidelines, PIC/S-Guides, ISPE Guides
Welche Branchen bewegen sich in einem GMP-regulierten Umfeld?
Diese Branchen müssen sich nach den GMP-Richtlinien und –Normen richten:
Welchen Anforderungen muss eine GMP-gerechte Dokumentation entsprechen?
Eine GMP-gerechte Dokumentation muss diese Anforderungen erfüllen:
- Sie muss in Schriftform vorliegen.
- Sie muss richtig und vollständig sein.
- Sie muss klar formuliert und immer aktuell gehalten sein.
- Sie muss stets verfügbar sein.
- Die Dokumentation muss vom zuständigen Qualitätsbeauftragten freigegeben und unterschrieben werden.
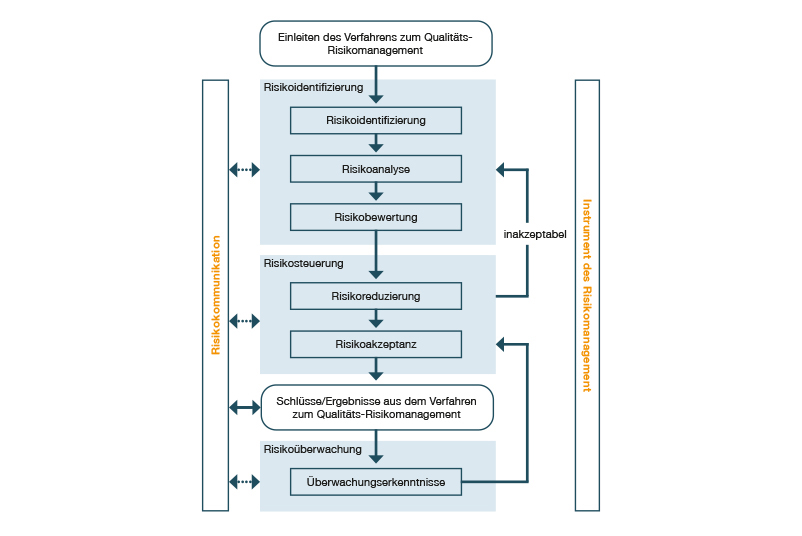
Wie wird das Risikomanagement in der Guideline ICH Q9 definiert?
Beschrieben wird der Risikomanagementprozess in der Guideline ICH Q9, die im Teil III des EU-GMP-Leitfadens fest verankert ist. Ihr Ziel ist es, einen umfassenden Prozess der Risikobeurteilung, -steuerung und –überwachung (siehe Abb. unten) über den Produkt-Lebenszyklus hinweg aufzubauen und damit potenzielle Fehler und Gefahren für die Produktqualität unter Kontrolle zu bringen. Viele dieser Maßnahmen werden im Rahmen von Risikoanalysen (z.B. FMEA) ermittelt und im Zuge von Qualifizierung und Validierung umgesetzt. Man spricht daher im GxP-Umfeld häufig von risikobasierter Qualifizierung und risikobasierter Validierung.
Erfahren Sie mehr in unserem Fachartikel:
Fachartikel Qualitätsrisikomanagement nach ICH Q9
Was sind die Grundsätze des Risikomanagements in GxP-regulierten Bereichen?
Folgende Prinzipien sollten beachtet werden:
- Die Bewertung der Qualitätsrisiken sollte auf wissenschaftlichen Erkenntnissen beruhen und immer vor dem Hintergrund des Patientenschutzes gesehen werden
- Der Grad des Aufwands, der Formalitäten und der Dokumentation des Verfahrens zum Qualitätsrisikomanagement sollte der Risikostufe angemessen sein
Welche Ziele verfolgt das Risikomanagement in GxP-regulierten Bereichen?
- Schwachstellen und Risiken hinsichtlich der Produktqualität und Patientensicherheit sollen aufgedeckt werden
- Entscheidungen sollen rational und nachvollziehbar getroffen werden
- Qualitätskontroll- und Lenkungsmaßnahmen sollen risikobasiert definiert werden
- Interdisziplinärer Austausch zur verbesserten Risikoidentifizierung soll gefördert werden
- Fehler sollen proaktiv und präventiv vermieden oder gesteuert werden
- Entscheidungsprozesse werden für alle Beteiligten transparent, z. B. auch gegenüber Behörden
Welche Methode eignet sich für Risikoanalysen von Unternehmen mit GxP-Compliance Anforderungen?
Für Risikoanalysen wird häufig die FMEA-Methode angewandt (FMEA = Failure Mode and Effects Analysis). Der Vorteil dieser ist, dass sie auch sehr umfangreiche Betrachtungen strukturiert abbilden kann. Es kann aber auch hilfreich sein, gerade bei komplexeren Prozessen oder Anlagen, zunächst Brainstorming-Methoden wie das Ishikawa-Diagramm bzw. Fischgrät-Diagramm anzuwenden.